|
|
|
OBIETTIVO
Verificare l'esistenza della relazione di proporzionalità inversa presente tra la PRESSIONE e il VOLUME
di un GAS a TEMPERATURA costante
(LEGGE DI BOYLE) : P * V = K.
STRUMENTI

PROCEDURA
- Abbiamo riempito i due tubicini di plastica, collegati dal tubo di gomma, con del MERCURIO. Questo, per il
PRINCIPIO DEI VASI COMUNICANTI (principio in base al quale un liquido contenuto in
recipienti comunicanti sale in essi allo stesso livello, indipendentemente dalla loro
forma e dal loro diametro), raggiungerà lo stesso livello e perciò lo stesso volume sia
a destra che a sinistra.
- Successivamente abbiamo chiuso la valvola di sinistra del manometro, in modo da
imprigionare una determinata quantità di aria, che sarà poi il gas preso in
considerazione per la verifica della legge.
- Abbiamo alzato il tubo di destra, in modo da riportare il livello del mercurio alla
stessa altezza. Così la pressione esercitata sul gas diventa uguale a quella atmosferica.
- Dopo aver letto quest'ultima sul BAROMETRO, abbiamo alzato ancora il tubo di destra
per aumentare la pressione.
- Abbiamo misurato, successivamente, l'altezza del gas imprigionato nel tubo di
sinistra, e quindi il DISLIVELLO del mercurio.
- Per calcolare il volume del gas misuriamo il diametro del tubo di plastica,
calcoliamo l'area di una sezione e la moltiplichiamo per tutte le altezze del gas
rilevate.
- Dopo aver calcolato la costante di P*V, abbiamo inserito tutti i dati in una
tabella e proceduto alla costruzione del grafico.
- Infine abbiamo tratto le conclusioni.
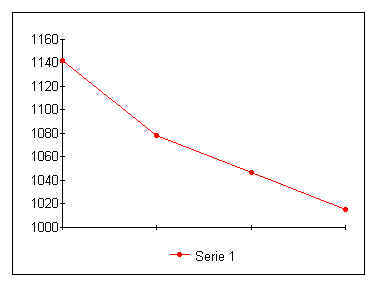
TABELLA

GRAFICO
CONCLUSIONI
Dall’analisi dei dati ricavati dall’esperienza possiamo
dedurre l’esistenza di una relazione di proporzionalità inversa tra la pressione
dell’aria e il suo volume a temperatura costante. Questo viene
individuato dal grafico che mostra un ramo di iperbole.
Bisogna sottolineare che durante la prova non varia la massa del gas ma la sua densità, in base alla
pressione a cui viene sottoposta. In teoria, se riuscissimo a raggiungere una pressione
tale che il volume dell’aria fosse compresso al massimo, potremmo riuscire a rendere liquido
il gas. In realtà questo non è possibile perché a tale pressione (difficilmente
raggiungibile in laboratorio) il tubo non reggerebbe e scoppierebbe. Nello svolgimento
dell'esperienza è stato necessario porre molta attenzione perché il processo di raccolta
dei dati è risultato delicato e il minimo errore di
lettura poteva portare al fallimento dell'intera esperienza. Esempi in natura. |


