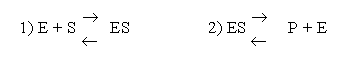

Maude Menten
(1879 - 1960)

Maude Menten
E' stata una delle più versatili e innovative ricercatrici in chimica della prima metà del nostro secolo.
Laureatasi in chimica nel 1904 all'università di Toronto (Canada), vi ottenne nel 1911 il dottorato; dapprima si occupò di fisiologia presso l'università di Toronto, fu ricercatrice poi al Rockefeller Institute e alla Western Reserve University.
A Berlino con Michaelis definì l'equazione detta Michaelis-Menten sulle reazioni enzimatiche. Questa equazione, fondamentale per comprendere come un enzima reagisce con un determinato substrato, esprime la velocità di una reazione enzimatica in funzione della concentrazione del substrato. Il meccanismo ipotizzato prevede che la reazione avvenga in due fasi: 1) la formazione di un complesso (ES) tra l'enzima (E) e il suo substrato (S), seguito da 2) la decomposizione del complesso nel prodotto (P) e la rigenerazione enzimatica.
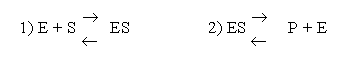
La velocità di reazione è proporzionale alla concentrazione del complesso (ES) formatosi. L'espressione Michaelis-Menten da ciò derivata è:
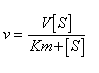
dove v è la velocità di reazione, V è la sua massima velocità , Km è la costante di Michaelis e [S] è la concentrazione del substrato.
Dopo gli studi a Berlino ottenne un dottorato di ricerca in biochimica all'Università di Chicago e divenne docente nella facoltà di Medicina all'Università di Pittsburgh. Lavorò anche come primario di patologia all'Ospedale per bambini di Pittsburgh. Divenne famosa per i suoi sforzi nella lotta contro le malattie infantili e come insegnante appassionata al suo lavoro.
Nel 1944 pubblicò (con Junge e Green) un articolo sulla nuova tecnica azo-dye per la dimostrazione in chimica istologica dell'enzima alcalinofosfatasi nelle cellule. Più tardi Menten e Janouch confermarono l'applicazione pratica del metodo in ricerche biologiche, mostrando che la diminuzione dell'enzima era direttamente collegata al grado di danno renale in un campione sperimentale. Prima dello sviluppo del metodo azo-dye la dimostrazione di enzimi all'interno delle cellule si basava su procedimenti lenti che prevedevano l'uso di calcio e/o di sali di cobalto, i cui risultati erano ambigui. Nella medicina odierna, uno degli altri utilizzi dell'azo-dye consiste nella diagnosi delle diverse forme di leucemia, che è essenziale per determinare il tipo di cura appropriata al singolo paziente. Le tecniche azo-dye sono, inoltre, diventate un importante strumento in molte aree della biologia.
Nel 1944, Menten e i suoi colleghi furono i primi ad usare un'altra tecnica importante, l'elettroforesi, per risolvere un problema biochimico. Nel 1940 non si conosceva quasi nulla della struttura a livello molecolare dei globuli rossi o emoglobina (la proteina dai pigmenti rossi che trasporta l'ossigeno). Si era intuito, tuttavia, che l'emoglobina "F" del feto di mammifero era biochimicamente diversa dall'emoglobina "A" dei globuli rossi di un adulto. Menten riuscì a separare i due tipi di emoglobina permettendo così lo studio delle loro diverse proprietà chimiche. Il principio della separazione elettroforetica dipende dal fatto che le molecole attraversano un campo elettrico a diverse velocità. Questi valori dipendono dalla dimensione e dalle cariche accumulate dalle proteine. Alcuni anni più tardi Linus Pauling utilizzò il metodo dell'elettroforesi dell'emoglobina per dimostrare che nelle cellule malate la molecola "S" era diversa dalla molecola "A". Questa scoperta introdusse il concetto, attualmente ben noto, di malattia molecolare.